➝ la masse volumique : ρ = m/v
Si ρ = m/v alors :
- m = ρ x v
- v = m/ρ
Si ρcorps est plus ρliquide alors le corps flotte. De plus, si plusieurs liquides non miscibles sont dans un même récipient, c’est le plus dense qui se retrouve au fond.
➝ la densité : d = ρcorps / ρeau (ρeau = 1g/cm3)
➝ poucentage massique : (m/mtotal) x 100
➝ pourcentage volumique : (v/vtotal) x 100
➝ Concentration en soluté d’une solution : t = msoluté/vsolution (ATTENTION : À NE PAS CONFONDRE AVEC LA MASSE VOLUMIQUE)
➝ La préparation de solution :
- préparation d’une solution par dissolution d’un solide
- préparation d’une solution par dilution d’une solution mère :
Facteur de dilution : F = tmère/tfille = Vfille/Vmère
➝ Les solutions :
- Le soluté (exemple : du sucre)
- le solvant (exemple : de l’eau)
Si le solvant est de l’eau, alors la solution est une solution aqueuse (comme dans l’exemple si dessous).
➝ Les mélange et les corps purs :
- Les mélanges : des substances composés de plusieurs espèces chimiques différentes
- Les corps purs : des substances composés d’une seule espèce chimique
La chromaphotographie sur couche mince (CCM) permet de savoir si une solution est un corps pur ou un mélange. Si c’est un mélange, cette technique permet de savoir les différentes espèces chimiques le composant.
La composition d’un atome :
- Noyau : neutrons (charge neutre) et protons (charge positive)
- Cortège éléctrique : éléctrons (charge négative)
Un atome est éléctriquement neutre car il possède autant de protons que d’éléctrons, les charges se compensent.
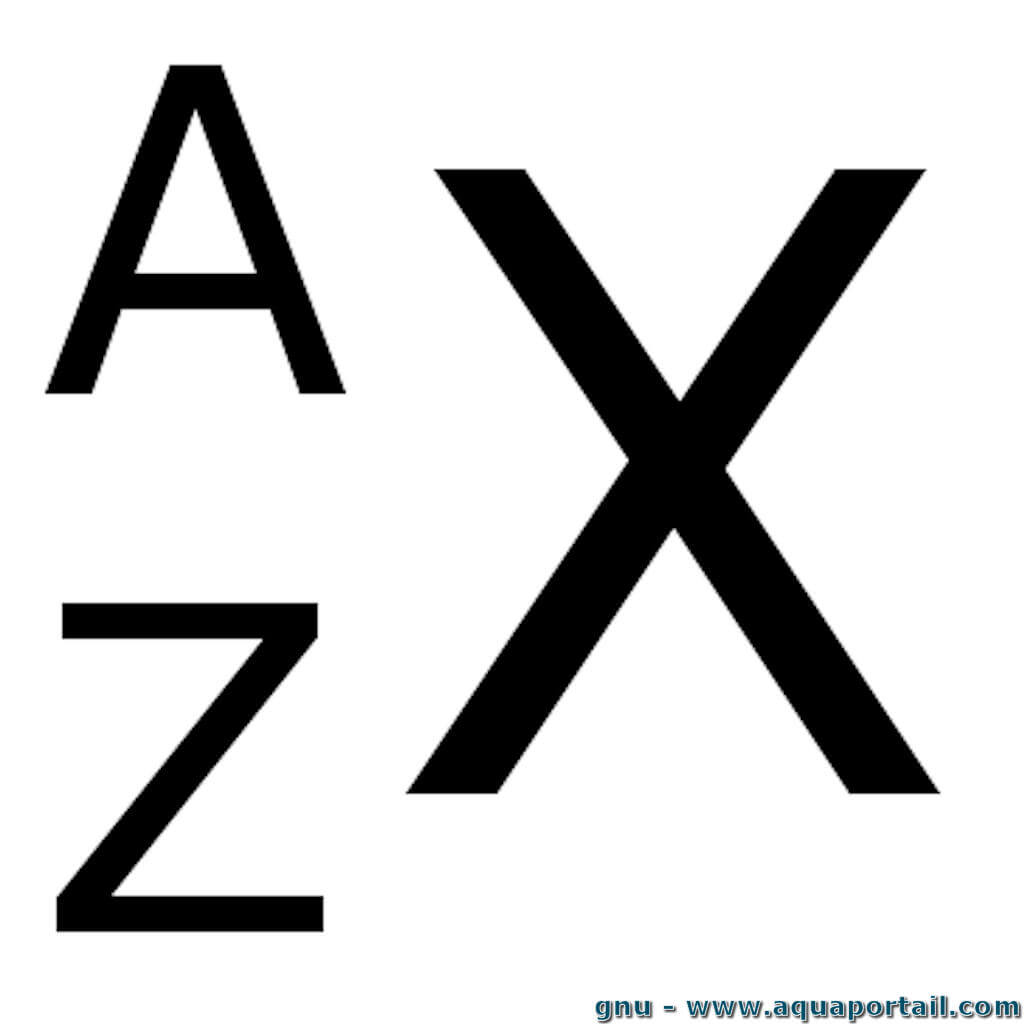
- X : le symbole de l’atome
- A : le nombre de nucléons (protons et neutrons)
- Z : le nombre de protons
Pour calculer la masse d’un atome, il faut faire le produit du nombre de nucléons et de la masse d’un nucléons : A x mnucléons (mnucléons = 1,67 x 10-27).
Un isotope possède le même nombre de protons (Z) mais pas le même nombre de nucléons (A) qu’un atome.
Exemple : 612C 614C Les deux possiède le même nombre de protons mais pas le même nombre de nucléons (12 ≠ 14)
Calcule de la charge du cortège d’un atome : Z x (-e) = -Z x e
Les ions sont des atomes ayant gagnés ou perdu des éléctrons :
- Les cations : ont une charge positive (manque d’éléctrons)
- Les anions : ont une charge négative (possède trop d’éléctrons)
