- Lorsqu’on dissout un composant ionique, les ions se séparent et se dispersent dans l’eau, ils sont libres.
- Quand des ions sont chargés, cela provoque un déplacement de charge et crée donc un courant électrique.
Chlorure de sodium
NaCl(s) ➝ Cl– (aq) + Na+(aq)
Solution ionique : (Na+, Cl–)
Chlorure de fer (II)
FeCl2(s) ➝ 2Cl–(aq) + Fe 2+(aq)
Solution ionique : (Fe2+, Cl–)
Sulfate de fer (III)
Fe2(SO4)3(s) ➝ 3SO42-(aq) + 2Fe3+(aq)
Solution ionique : (Fe3+, SO42-)
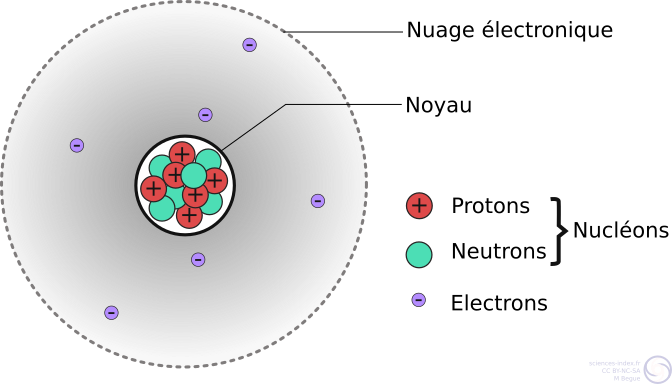
- Taille d’un atome : 10-10 m
- Taille d’un noyau d’atome : 10-15 m
Le noyau a toujours une charge positive et l’atome est toujours électriquement neutre puisqu’il y a le même nombre de protons que d’électrons.
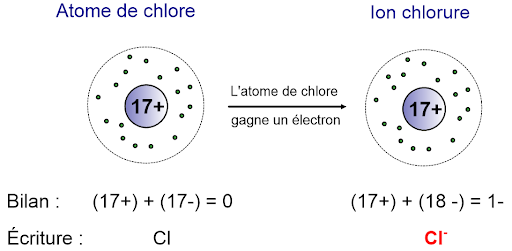
Un cation est un ion positif et un anion est un ion négatif
- Ion sulfate : SO42-
- Ion ammonium : NH4+
- Solides ioniques : un empilement régulier de cations et d’anions.
- Solution aqueuse ionique : solution dans laquelle se trouve des anions et des cations libres.
- Matière neutre : lorsque le nombre de cations est compensé par le nombre d’anions.
Sulfate d’aluminium :
Solution ionique : (2Al3+, 3SO42-)
Solide ionique : Al2(SO4)3
Pour détecter les ions métalliques, il faut faire un test à la soude (hydroxyde de sodium).
➝ Si le précipité est solide, alors la solution est électriquement neutre.
Pour détecter les ions chlorure, il faut faire un test au nitrate d’argent.
- Ion fer (II) ➝ Fe2+ Ion fer (III) ➝ Fe3+
- Ion cuivre ➝ Cu2+ Ion zinc ➝ Zn2+
- Ion aluminium ➝ Al3+
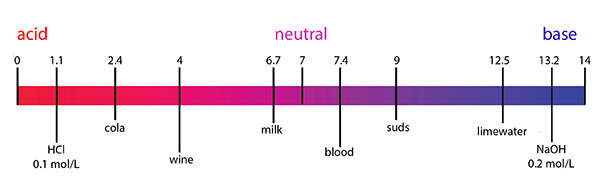
Dans le mélange d’eau et d’une solution neutre, il y a autant d’ions hydroxydes que d’ions hydrogènes.
Dans la solution acide, il y plus d’ions hydrogènes que d’ions hydroxydes.
Dans la solution basique, il y plus d’ions hydroxydes que d’ions hydrogènes.