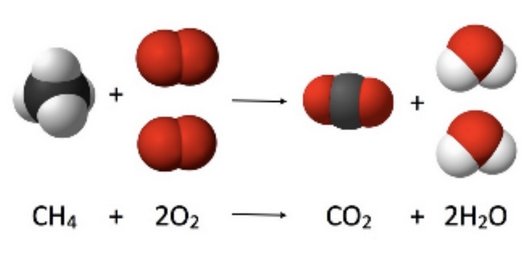
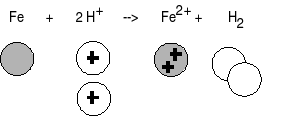Transformation chimique
➝ Certaines espèces chimiques disparaissent (les réactifs) et se transforment en nouvelles espèces chimiques (les produits).
Pour qu’il y ait transformation chimique, il faut qu’il y ait :
- soit la disparition d’une ou plusieurs espèces chimiques ;
- soit l’apparition d’une ou plusieurs espèces chimiques ;
- soit les 2.
Les signes : gaz, changement de couleur, variation du pH.
Transformation physique
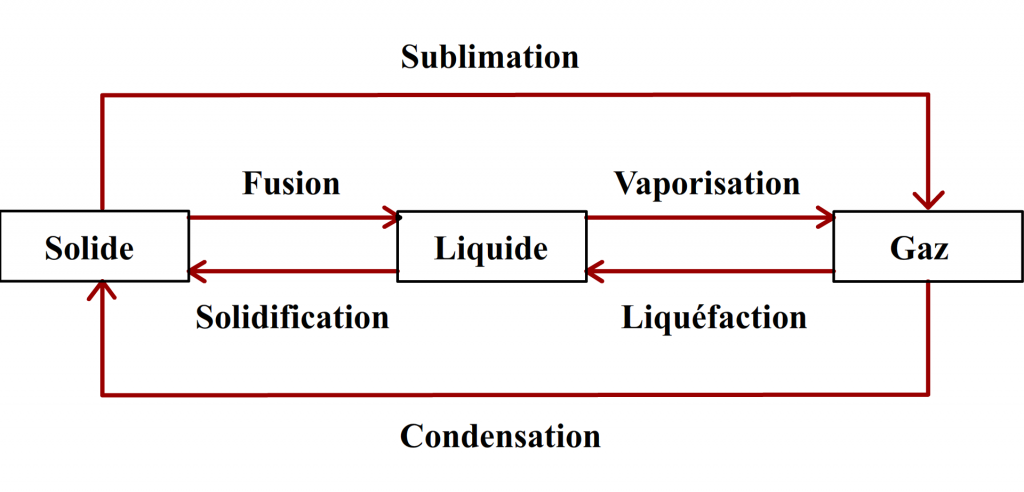
➝ Aucune espèce chimique ne disparaît ou n’apparaît, seulement l’aspect et/ou l’état physique change(nt) (il est possible de retrouver la/les espace(s) chimique(s) comme elle(s) étai(en)t au départ).
La matière ne change pas de nature, exemple :
L’eau : après une transformation physique, de l’eau reste de l’eau mais elle peut être sous un autre état physique (on peut aussi revenir à l’aspect de départ).
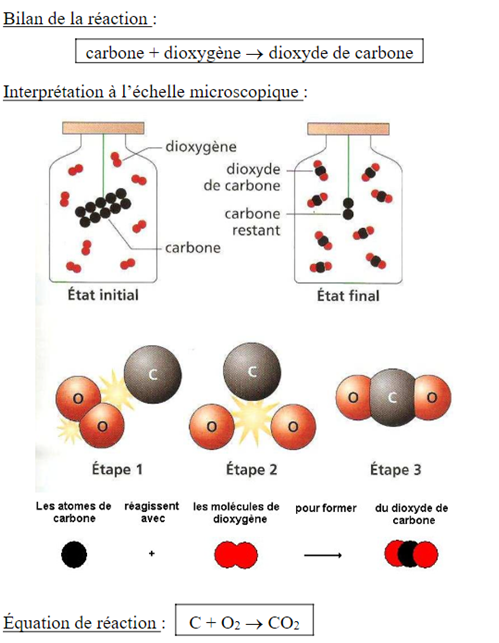
Transformation chimique faisant intervenir des atomes et des molécules :
La conservation
“Rien ne se perd, rien ne se crée, tous se transforme”, Lavoisier.
Durant une réaction chimique, les atomes dans les réactifs ne disparaissent pas ; ils se réorganisent pour former de nouvelles espèces chimiques qui sont les produits (il n’y a pas non plus de nouveaux atomes qui apparaissent).
L’équation de réaction
➝ Sert à décrire les réactifs et les produits avec des formules. Elles indiquent aussi dans quelles proportions ils interviennent au cours de la transformation pour respecter la conservation des atomes.
Transformation chimique faisant intervenir des ions :
On conserve les éléments chimiques et la charge électrique